- TRANSITION ORDRE-DÉSORDRE
- TRANSITION ORDRE-DÉSORDREDans un gaz idéal, les atomes (ou les molécules) sont distribués parfaitement au hasard les uns par rapport aux autres: c’est un modèle de désordre géométrique parfait. Dans un cristal idéal, l’arrangement des atomes donne, au contraire, l’image de l’ordre parfait. Entre ces deux perfections, dans le désordre et dans l’ordre, l’observation des états naturels de la matière conduit à l’analyse des écarts à l’ordre ou au désordre: c’est une branche de la physique qui est stimulée par l’importance d’applications telles que l’élaboration de matériaux possédant des propriétés mécaniques, électriques, optiques ou magnétiques particulières.1. Désordre réticulaire et désordre topologiqueL’ordre qui règne dans un cristal est caractérisé par le fait que l’arrangement des atomes autour d’un point r se retrouve identique en tous les points r + l , l étant l’une quelconque des translations du réseau :
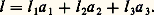 On peut tout aussi bien dire que l’édifice cristallin est ramené en coïncidence avec lui-même par l’une quelconque des translations l . Dans un tel assemblage, la notion de périodicité se substitue donc, à l’échelle atomique, à celle d’homogénéité.Défauts localisésPlusieurs types de défauts peuvent venir troubler cette parfaite périodicité cristalline. D’abord l’agitation thermique, qui déplace légèrement les atomes autour de leurs positions moyennes d’équilibre, mais aussi des défauts localisés. Imaginons qu’un cristal formé d’atomes de type A (par exemple du fer) contienne quelques atomes de type B (par exemple de l’aluminium); un atome B pourra ainsi venir se substituer à un atome A, constituant une rupture locale de la périodicité: cette irrégularité est nommée défaut ponctuel . Ici, le défaut est «par substitution». Dans d’autres cas, l’atome «étranger», au lieu de prendre la place d’un atome normal, pourra venir se loger dans un interstice de l’édifice cristallin, en créant localement une déformation: le défaut sera qualifié d’interstitiel . Bien d’autres types de défauts ponctuels ont été observés, des plus simples aux plus complexes. Parmi les plus simples, citons encore les défauts du type lacune : il s’agit simplement d’un trou dans la structure, c’est-à-dire de l’absence d’un atome en un site où il devrait normalement se trouver (cf. CRISTAUX – Défauts dans les cristaux).Un défaut ponctuel provoque dans le milieu, à l’échelle atomique, une anomalie locale de potentiel qui peut trapper des électrons sur des niveaux quantifiés d’énergie, tout comme le font les noyaux des atomes. Il en résulte une spectroscopie des défauts, et les cristaux peuvent être colorés du fait de la présence de ces imperfections, que l’on nomme alors, pour cette raison, des centres colorés .Les défauts peuvent être porteurs d’une charge électrique: en migrant sous l’effet d’un champ électrique, ils provoquent un courant. On interprète ainsi la conductibilité des électrolytes solides qui, s’ils étaient parfaits, seraient isolants.Un traitement thermique des cristaux peut les guérir plus ou moins de leurs défauts ponctuels (recuit) ou, au contraire (chauffe suivie de trempe), les en doter.Dans la catégorie des défauts cristallins localisés, il faut aussi citer les dislocations . Ce sont des défauts qui s’étendent le long d’une ligne dans le milieu cristallin. La présence de dislocations et la faculté qu’elles ont de migrer dans le cristal permettent d’expliquer, en particulier, la plasticité des métaux.Désordre réticulaireL’objet de cet article n’est pas de décrire en détail les défauts localisés, mais de s’intéresser aux divers types de désordres non localisés. Considérons donc un composé binaire AB et supposons qu’à l’état solide sa structure cristalline puisse être représentée par la figure 1 a (structure réduite à un schéma à deux dimensions au lieu de trois, pour simplifier). Si A et B représentent deux ions tels que, par exemple, Cl size=1漣 et Na+, tous les premiers voisins d’un ion A sont du type B, et réciproquement, en raison des forces électrostatiques d’interaction, attractives entre A et B et répulsives entre A et A ou B et B. Mais si A et B représentent les deux types d’atomes composant un alliage binaire, AlFe par exemple, les liaisons sont de type métallique, et on peut imaginer que l’énergie correspondant à une configuration parfaitement ordonnée (fig. 1 a) soit assez peu différente de celle d’une configuration désordonnée telle que celle qui est représentée par la figure 1 b. L’ensemble des positions des sites atomiques est conservé, le désordre n’intervient que dans l’occupation de ces positions. On peut dire encore que la matrice du réseau cristallin est conservée, mais que les atomes A et B occupent au hasard les sites de cette matrice. C’est le désordre réticulaire . L’état schématisé en a est parfaitement ordonné, l’état b est désordonné. Le passage de l’un à l’autre est nommé «transformation ordre-désordre».L’exemple des alliages n’est qu’une des illustrations possibles du concept de désordre réticulaire, qui est aussi bien adapté, par exemple, à la description des transformations magnétiques . Dans un solide ferromagnétique, les atomes porteurs de moments magnétiques occupent un ensemble de sites structuraux qui se répètent régulièrement de maille en maille, et les moments sont tous parallèles à une même direction, aux légères fluctuations dues à l’agitation thermique près. À la température du point de Curie, la substance ferromagnétique devient paramagnétique: les atomes porteurs de moments restent en place dans la structure, mais leurs moments s’orientent au hasard, l’influence de l’agitation thermique ayant pris le pas sur l’énergie d’interaction entre moments (passage de la configuration schématique de la fig. 2 a à celle de la fig. 2 b). L’état est alors magnétiquement désordonné: le passage par le point de Curie est une transformation ordre-désordre magnétique. Tous les états magnétiques ordonnés (antiferromagnétiques, ferrimagnétiques, hélimagnétiques...) sont justiciables du même genre de raisonnement.Un troisième type de désordre réticulaire peut être illustré à partir de la structure de la glace, et il est, pour cette raison, généralement désigné sous le titre de désordre réticulaire du type glace . Dans la structure de la glace, de formule chimique H2O, les ions oxygène sont distribués selon un arrangement dans lequel chacun d’eux se trouve au centre d’un tétraèdre régulier dont les quatre sommets sont eux-mêmes occupés par un ion oxygène. Les ions hydrogène (protons), beaucoup plus petits, se placent sur les liaisons O 漣O entre les ions oxygène, mais pas à mi-distance entre ces ions. Ainsi, chaque ion oxygène s’approprie au total deux ions hydrogène (et non quatre), et l’on retrouve, à l’état solide, une configuration qui reproduit localement l’arrangement des atomes dans la molécule d’eau H2O.Mais l’arrangement des protons n’est pas nécessairement le même dans chaque maille du cristal. La figure 3 donne une idée de ce désordre dans un schéma réduit, pour simplifier, à deux dimensions. Les gros cercles blancs représentent l’ensemble parfaitement ordonné des ions A (dans ce schéma plan, chaque ion est au centre d’un carré d’ions de même nature). Les petits cercles noirs représentent les ions B. On voit que chaque ion A est propriétaire de deux ions B (molécule AB2) et que, si l’arrangement des cercles blancs A est parfaitement régulier, celui des cercles noirs B ne l’est pas. La répartition des cercles noirs sur les sites possibles peut évidemment être réalisée d’un grand nombre de manières différentes (en fait, pour la glace, ce nombre est égal à (3/2)N si le nombre de liaisons est 2 N, ce qui explique l’existence d’une entropie S0 = Nkln (3/2) effectivement observée).Bien d’autres exemples pourraient être donnés de ce désordre du «type glace». Nous ne retiendrons que celui des cristaux ferroélectriques du genre KDP (phosphate de potassium, KH2P4). Dans ces cristaux, de même que dans la glace, les protons, qui lient les ions phosphates, peuvent occuper, sur une liaison, l’une ou l’autre de deux positions. Mais ici, du fait de la complexité de la structure, une direction se trouve privilégiée dans le cristal et, à basse température, un ordre se met en place tel que toutes les mailles cristallines aient la même configuration en ce qui concerne les liaisons hydrogène. Il en résulte une polarisation: le solide devient alors ferroélectrique. De même que les ferromagnétiques, les ferroélectriques présentent une transition ordre-désordre, avec une température critique Tc .Désordre topologiqueQuel que soit le type de désordre réticulaire envisagé ci-dessus, les structures décrites étaient caractérisées par la conservation, même dans l’état désordonné, d’une matrice régulière triplement périodique. Le désordre dit topologique est de toute autre nature. Sa description est centrée sur la considération de l’état liquide ou de l’état vitreux et non plus de l’état cristallin: ici, il n’est plus question de matrices périodiques.La silice Si2 fournit une bonne illustration. Chaque ion silicium Si4+ est au centre d’un tétraèdre régulier dont les quatre sommets sont occupés par des ions oxygène 2 size=1漣. Ces tétraèdres Si4 forment les éléments de base de la structure. Ils sont liés entre eux par tous leurs sommets. Chaque sommet étant ainsi commun à deux tétraèdres, la formule globale du composé est bien Si2. Dans les diverses formes cristallines de la silice, dont la plus commune est le quartz, l’arrangement des tétraèdres les uns par rapport aux autres est périodiquement régulier. Dans la silice amorphe, désordonnée, les tétraèdres Si4 restent indéformables, mais leur arrangement n’est plus régulier.La figure 4 a donne un schéma à deux dimensions d’un composé de formule A2B3 dont l’élément structural est l’haltère A2B, qui joue ici le rôle du tétraèdre Si4: les cercles blancs symbolisent des atomes d’espèce B et les noirs des atomes d’espèce A. Chaque atome A étant commun à trois haltères, la formule globale est bien A2/3B, c’est-à-dire A2B3. Les éléments structuraux sont ici ordonnés selon un arrangement périodique. Dans la figure 4 b, les haltères A2B restent inchangées, mais leur arrangement n’est plus périodique. Les angles de liaisons ABA restent tous égaux à 1800, mais les angles BAB varient d’un point à un autre autour de la valeur moyenne de 1200. De même, dans la silice amorphe, les angles de liaisons O 漣Si 漣O restent égaux à très peu près à 1090 28 (c’est-à-dire que les tétraèdres Si4 restent réguliers, à très peu près), tandis que les liaisons Si 漣O 漣Si varient largement d’un point à l’autre entre des valeurs extrêmes de 1200 et 1800.La description géométrique de ces milieux solides amorphes ou vitreux est identique à celle des milieux liquides . Les fonctions généralement employées pour cette description sont dites fonctions de distribution atomique . Elles sont de nature statistique et peuvent s’écrire sous la forme:
On peut tout aussi bien dire que l’édifice cristallin est ramené en coïncidence avec lui-même par l’une quelconque des translations l . Dans un tel assemblage, la notion de périodicité se substitue donc, à l’échelle atomique, à celle d’homogénéité.Défauts localisésPlusieurs types de défauts peuvent venir troubler cette parfaite périodicité cristalline. D’abord l’agitation thermique, qui déplace légèrement les atomes autour de leurs positions moyennes d’équilibre, mais aussi des défauts localisés. Imaginons qu’un cristal formé d’atomes de type A (par exemple du fer) contienne quelques atomes de type B (par exemple de l’aluminium); un atome B pourra ainsi venir se substituer à un atome A, constituant une rupture locale de la périodicité: cette irrégularité est nommée défaut ponctuel . Ici, le défaut est «par substitution». Dans d’autres cas, l’atome «étranger», au lieu de prendre la place d’un atome normal, pourra venir se loger dans un interstice de l’édifice cristallin, en créant localement une déformation: le défaut sera qualifié d’interstitiel . Bien d’autres types de défauts ponctuels ont été observés, des plus simples aux plus complexes. Parmi les plus simples, citons encore les défauts du type lacune : il s’agit simplement d’un trou dans la structure, c’est-à-dire de l’absence d’un atome en un site où il devrait normalement se trouver (cf. CRISTAUX – Défauts dans les cristaux).Un défaut ponctuel provoque dans le milieu, à l’échelle atomique, une anomalie locale de potentiel qui peut trapper des électrons sur des niveaux quantifiés d’énergie, tout comme le font les noyaux des atomes. Il en résulte une spectroscopie des défauts, et les cristaux peuvent être colorés du fait de la présence de ces imperfections, que l’on nomme alors, pour cette raison, des centres colorés .Les défauts peuvent être porteurs d’une charge électrique: en migrant sous l’effet d’un champ électrique, ils provoquent un courant. On interprète ainsi la conductibilité des électrolytes solides qui, s’ils étaient parfaits, seraient isolants.Un traitement thermique des cristaux peut les guérir plus ou moins de leurs défauts ponctuels (recuit) ou, au contraire (chauffe suivie de trempe), les en doter.Dans la catégorie des défauts cristallins localisés, il faut aussi citer les dislocations . Ce sont des défauts qui s’étendent le long d’une ligne dans le milieu cristallin. La présence de dislocations et la faculté qu’elles ont de migrer dans le cristal permettent d’expliquer, en particulier, la plasticité des métaux.Désordre réticulaireL’objet de cet article n’est pas de décrire en détail les défauts localisés, mais de s’intéresser aux divers types de désordres non localisés. Considérons donc un composé binaire AB et supposons qu’à l’état solide sa structure cristalline puisse être représentée par la figure 1 a (structure réduite à un schéma à deux dimensions au lieu de trois, pour simplifier). Si A et B représentent deux ions tels que, par exemple, Cl size=1漣 et Na+, tous les premiers voisins d’un ion A sont du type B, et réciproquement, en raison des forces électrostatiques d’interaction, attractives entre A et B et répulsives entre A et A ou B et B. Mais si A et B représentent les deux types d’atomes composant un alliage binaire, AlFe par exemple, les liaisons sont de type métallique, et on peut imaginer que l’énergie correspondant à une configuration parfaitement ordonnée (fig. 1 a) soit assez peu différente de celle d’une configuration désordonnée telle que celle qui est représentée par la figure 1 b. L’ensemble des positions des sites atomiques est conservé, le désordre n’intervient que dans l’occupation de ces positions. On peut dire encore que la matrice du réseau cristallin est conservée, mais que les atomes A et B occupent au hasard les sites de cette matrice. C’est le désordre réticulaire . L’état schématisé en a est parfaitement ordonné, l’état b est désordonné. Le passage de l’un à l’autre est nommé «transformation ordre-désordre».L’exemple des alliages n’est qu’une des illustrations possibles du concept de désordre réticulaire, qui est aussi bien adapté, par exemple, à la description des transformations magnétiques . Dans un solide ferromagnétique, les atomes porteurs de moments magnétiques occupent un ensemble de sites structuraux qui se répètent régulièrement de maille en maille, et les moments sont tous parallèles à une même direction, aux légères fluctuations dues à l’agitation thermique près. À la température du point de Curie, la substance ferromagnétique devient paramagnétique: les atomes porteurs de moments restent en place dans la structure, mais leurs moments s’orientent au hasard, l’influence de l’agitation thermique ayant pris le pas sur l’énergie d’interaction entre moments (passage de la configuration schématique de la fig. 2 a à celle de la fig. 2 b). L’état est alors magnétiquement désordonné: le passage par le point de Curie est une transformation ordre-désordre magnétique. Tous les états magnétiques ordonnés (antiferromagnétiques, ferrimagnétiques, hélimagnétiques...) sont justiciables du même genre de raisonnement.Un troisième type de désordre réticulaire peut être illustré à partir de la structure de la glace, et il est, pour cette raison, généralement désigné sous le titre de désordre réticulaire du type glace . Dans la structure de la glace, de formule chimique H2O, les ions oxygène sont distribués selon un arrangement dans lequel chacun d’eux se trouve au centre d’un tétraèdre régulier dont les quatre sommets sont eux-mêmes occupés par un ion oxygène. Les ions hydrogène (protons), beaucoup plus petits, se placent sur les liaisons O 漣O entre les ions oxygène, mais pas à mi-distance entre ces ions. Ainsi, chaque ion oxygène s’approprie au total deux ions hydrogène (et non quatre), et l’on retrouve, à l’état solide, une configuration qui reproduit localement l’arrangement des atomes dans la molécule d’eau H2O.Mais l’arrangement des protons n’est pas nécessairement le même dans chaque maille du cristal. La figure 3 donne une idée de ce désordre dans un schéma réduit, pour simplifier, à deux dimensions. Les gros cercles blancs représentent l’ensemble parfaitement ordonné des ions A (dans ce schéma plan, chaque ion est au centre d’un carré d’ions de même nature). Les petits cercles noirs représentent les ions B. On voit que chaque ion A est propriétaire de deux ions B (molécule AB2) et que, si l’arrangement des cercles blancs A est parfaitement régulier, celui des cercles noirs B ne l’est pas. La répartition des cercles noirs sur les sites possibles peut évidemment être réalisée d’un grand nombre de manières différentes (en fait, pour la glace, ce nombre est égal à (3/2)N si le nombre de liaisons est 2 N, ce qui explique l’existence d’une entropie S0 = Nkln (3/2) effectivement observée).Bien d’autres exemples pourraient être donnés de ce désordre du «type glace». Nous ne retiendrons que celui des cristaux ferroélectriques du genre KDP (phosphate de potassium, KH2P4). Dans ces cristaux, de même que dans la glace, les protons, qui lient les ions phosphates, peuvent occuper, sur une liaison, l’une ou l’autre de deux positions. Mais ici, du fait de la complexité de la structure, une direction se trouve privilégiée dans le cristal et, à basse température, un ordre se met en place tel que toutes les mailles cristallines aient la même configuration en ce qui concerne les liaisons hydrogène. Il en résulte une polarisation: le solide devient alors ferroélectrique. De même que les ferromagnétiques, les ferroélectriques présentent une transition ordre-désordre, avec une température critique Tc .Désordre topologiqueQuel que soit le type de désordre réticulaire envisagé ci-dessus, les structures décrites étaient caractérisées par la conservation, même dans l’état désordonné, d’une matrice régulière triplement périodique. Le désordre dit topologique est de toute autre nature. Sa description est centrée sur la considération de l’état liquide ou de l’état vitreux et non plus de l’état cristallin: ici, il n’est plus question de matrices périodiques.La silice Si2 fournit une bonne illustration. Chaque ion silicium Si4+ est au centre d’un tétraèdre régulier dont les quatre sommets sont occupés par des ions oxygène 2 size=1漣. Ces tétraèdres Si4 forment les éléments de base de la structure. Ils sont liés entre eux par tous leurs sommets. Chaque sommet étant ainsi commun à deux tétraèdres, la formule globale du composé est bien Si2. Dans les diverses formes cristallines de la silice, dont la plus commune est le quartz, l’arrangement des tétraèdres les uns par rapport aux autres est périodiquement régulier. Dans la silice amorphe, désordonnée, les tétraèdres Si4 restent indéformables, mais leur arrangement n’est plus régulier.La figure 4 a donne un schéma à deux dimensions d’un composé de formule A2B3 dont l’élément structural est l’haltère A2B, qui joue ici le rôle du tétraèdre Si4: les cercles blancs symbolisent des atomes d’espèce B et les noirs des atomes d’espèce A. Chaque atome A étant commun à trois haltères, la formule globale est bien A2/3B, c’est-à-dire A2B3. Les éléments structuraux sont ici ordonnés selon un arrangement périodique. Dans la figure 4 b, les haltères A2B restent inchangées, mais leur arrangement n’est plus périodique. Les angles de liaisons ABA restent tous égaux à 1800, mais les angles BAB varient d’un point à un autre autour de la valeur moyenne de 1200. De même, dans la silice amorphe, les angles de liaisons O 漣Si 漣O restent égaux à très peu près à 1090 28 (c’est-à-dire que les tétraèdres Si4 restent réguliers, à très peu près), tandis que les liaisons Si 漣O 漣Si varient largement d’un point à l’autre entre des valeurs extrêmes de 1200 et 1800.La description géométrique de ces milieux solides amorphes ou vitreux est identique à celle des milieux liquides . Les fonctions généralement employées pour cette description sont dites fonctions de distribution atomique . Elles sont de nature statistique et peuvent s’écrire sous la forme: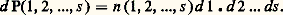 Elles expriment la probabilité d P de trouver à la fois le centre d’un atome dans l’élément de volume d 1 centré sur le point 1, un autre dans le volume d 2 centré au point 2..., et un autre dans le volume ds centré au point s . Dans un solide, qui, mis à part l’agitation thermique des atomes, peut être considéré comme figé, ces probabilités sont indépendantes du temps. Dans un liquide, elles représentent une valeur moyenne dans le temps.Considérons d’abord d P(1) = n (1) 練 d 1. C’est tout simplement la probabilité de trouver un atome en un point, donc la densité locale dans l’échantillon. Si d P(1) est indépendante du choix du point (1), l’échantillon est homogène. Prenons maintenant d P(1, 2) = n (1, 2) 練 d 1 練 d 2. C’est la probabilité de trouver simultanément un atome en (1) et un autre en (2). Si l’échantillon est homogène et isotrope, cette probabilité ne dépend que de la distance entre les points (1) et (2). La fonction n (1, 2) est dite fonction de distribution par paires. On la désigne aussi sous le nom de fonction de distribution radiale et on la note g (r ): si on fixe l’origine sur un atome, g (r ) donne la probabilité de trouver un autre atome à la distance r . Appliquée à un cristal, cette fonction se présente comme une suite discontinue de pics (distribution de fonctions de Dirac) car les distances interatomiques ont des valeurs discrètes, mais, dans un milieu désordonné, c’est une fonction continue (fig. 5). L’analyse de g (r ) permet de déterminer la valeur moyenne de la distance et du nombre des premiers voisins d’un atome donné dans le milieu étudié. En fait, l’essentiel des informations sur l’arrangement atomique est contenu dans cette fonction g (r ) qui décrit au mieux l’ordre local . L’interprétation de g (r ) est plus délicate lorsque la substance n’est pas un corps simple mais comporte plusieurs sortes d’atomes. Enfin, les fonctions de distribution de rang supérieur à deux, n (1, 2, 3), n (1, 2, 3, 4)..., permettent d’apporter quelques raffinements, mais sont d’un maniement beaucoup plus lourd.2. Paramètres d’ordre à longue et courte distanceRevenons maintenant au type de désordre que nous avons qualifié de réticulaire et cherchons à définir des paramètres susceptibles de le décrire quantitativement. Pour faire image, référons-nous au cas de l’alliage AB déjà évoqué et décrit dans la figure 1. Deux options peuvent être prises. La première consiste à s’intéresser au voisinage immédiat de chacun des atomes, c’est-à-dire à l’ordre local , ou ordre à courte distance , comme nous venons de le faire dans le cas du désordre topologique. Soit Z le nombre de premiers voisins d’un site de la matrice. Supposons que ce site soit occupé par un atome A, le nombre Z peut être divisé en deux parts: Z sites occupés par des atomes B et Z par des atomes A. Le rapport 兀 = (Z 漣 Z )/Z peut être utilisé pour décrire l’ordre local, les nombres Z et Z représentant les valeurs moyennes prises sur l’ensemble des sites de la matrice. 兀 est appelé paramètre d’ordre à courte distance. Dans l’état parfaitement ordonné, on a Z = Z et Z = 0, donc 兀 = 1. Dans l’état parfaitement désordonné, Z = Z , chaque site étant occupé avec la même probabilité par A ou B quel que soit son entourage, donc 兀 = 0. Dans tous les états intermédiaires, on a donc 0 麗 兀 麗 1.Mais le fait que, pour ce type de désordre, une matrice subsiste permet aussi de définir un ordre à grande distance . Désignons par 見 et 廓 les réseaux formés respectivement par les sites occupés, d’une part, par les atomes A et, d’autre part, par les atomes B dans l’état ordonné. Dans un état désordonné, soit 1 le nombre d’atomes A occupant des sites 見 (ou le nombre d’atomes B occupant des sites 廓), N2 le nombre d’atomes B occupant des sites 見 (ou le nombre d’atomes A occupant des sites 廓) et N = 1 + 2 le nombre total de sites. On définit le paramètre 﨡 d’ordre à grande distance par le rapport: 﨡 = (N1 漣 2)/N. Lorsque l’ordre est parfait (N1 = N, 2 = 0), 﨡 = 1; lorsque le désordre est statistiquement parfait dans l’ensemble de la matrice (N1 = 2), 﨡 = 0. Pour tous les états intermédiaires, 0 麗 | 﨡 | 麗 1.Ces définitions des deux paramètres 兀 et 﨡 se généralisent aisément au cas de composés de formule Am Bn , où m et n peuvent être différents de l’unité (exemple: AuCu3).Le paramètre d’ordre à courte distance, 兀, est appelé paramètre de Bethe. Il reflète essentiellement les effets de corrélations, d’interactions entre atomes premiers et, à la rigueur, deuxièmes voisins. Le paramètre d’ordre à longue distance, 﨡, est nommé paramètre de Bragg-Williams, du nom des deux auteurs qui ont introduit l’étude des corrélations à grande distance dans les alliages.Reprenant l’image de l’alliage AB, on peut définir une variable 靖 qui prend la valeur + 1 sur un site A et 漣 1 sur un site B. On obtient alors ce qu’il est convenu d’appeler un modèle d’Ising , qui permet, par exemple, de travailler sur l’ordre de spins magnétiques.Les définitions étant posées, les méthodes de la thermodynamique statistique peuvent être mises en œuvre pour l’étude des variations de 兀 et de 﨡 en fonction de la température et pour la recherche des corrélations possibles entre 兀 et 﨡, les données de départ étant les potentiels d’interaction entre couples d’atomes A-A, B-B, et A-B. Ce problème a donné lieu à un très grand nombre de travaux (Bethe, Bragg et Williams, Ising...) dans lesquels le degré des approximations introduites est plus ou moins grand. Cependant, même dans le cas d’une approximation relativement grossière, on est toujours conduit au résultat schématisé par la figure 6, qui représente les variations de 兀 et de 﨡 en fonction de la température. Il existe une température critique Tc au-dessus de laquelle l’ordre à grande distance disparaît totalement. Un résidu d’ordre local subsiste au-dessus de Tc et ne s’évanouit que progressivement lorsque la température s’élève. Ce résultat relatif au phénomène d’ordre-désordre réticulaire ne surprend pas. La disparition brutale de l’ordre à grande distance au-dessus de Tc est un phénomène tout à fait comparable à celui de la fusion, où l’ordre cristallin, la matrice, disparaît brutalement. En revanche, dans l’alliage désordonné au-dessus de Tc , comme dans un liquide, un ordre local subsiste qui ne s’atténue que très progressivement ou même jamais complètement.3. Manifestations physiques macroscopiquesPour mettre en évidence une transformation ordre-désordre, la méthode la plus directe est la diffraction des rayons X, celle des électrons ou celle des neutrons. Mais l’état d’ordre influe de façon plus ou moins marquée sur toutes les propriétés physiques du milieu, qu’elles soient électriques, magnétiques ou mécaniques.Diffraction des rayons X, des électrons et des neutronsConsidérons à nouveau la figure 1. Dans l’état d’ordre a, la périodicité, rigoureuse, est celle qui est indiquée par la flèche. Dans l’état de désordre, seule la matrice reste périodique, le solide ne l’étant plus au sens strict. Cela correspond, dans le schéma adopté, à une périodicité moyenne en b moitié de la périodicité rigoureuse en a. On sait que la figure de diffraction correspond à une transformation de Fourier de l’espace physique que constitue le milieu diffractant. À une périodicité du diffracteur deux fois moins serrée correspond donc une densité linéaire de taches de diffraction deux fois plus grande: ainsi, lorsque l’on passe du désordre à l’ordre, de nouvelles taches apparaissent sur les diagrammes de diffraction. Elles sont dites taches d’ordre ou de surstructure . Leur étude quantitative permet de caractériser le degré d’ordre et permet en particulier de calculer les paramètres d’ordre.Pour que les taches de surstructure apparaissent effectivement, encore faut-il que les pouvoirs diffusants individuels des atomes A et B soient différents, sinon les deux schémas a et b (fig. 1) apparaîtront pour les rayons X comme identiques. C’est pratiquement le cas si les atomes A et B sont très voisins dans la classification périodique. Il est alors nécessaire d’utiliser d’autres particules diffractantes pour lesquelles A et B apparaîtront comme différents: c’est ainsi que la diffraction des neutrons rend de grands services dans l’étude de l’ordre-désordre. La diffraction des électrons est utile elle aussi, plus spécialement pour l’observation des phénomènes dans les échantillons en couches minces.Dans le cas du désordre topologique, ce sont également les méthodes de diffraction qui sont les plus commodes pour déterminer la fonction de distribution radiale g (r ) qui se déduit, par transformation de Fourier, de la répartition des intensités dans un diagramme de diffraction, qui est alors continu, et non plus formé de faisceaux discrets. En diffraction de neutrons , il est même possible d’aller plus loin. En effet, l’énergie des neutrons thermiques utilisés étant faible, elle peut varier de quantités relativement notables lorsque les atomes sur lesquels les neutrons se diffractent sont en mouvement. En mesurant non seulement le nombre de neutrons diffusés dans les différentes directions, mais aussi leur énergie, on peut, par transformation de Fourier, en déduire une fonction de distribution spatio-temporelle (van Hove) qui permet de décrire non seulement la géométrie moyenne du milieu, mais encore son évolution dans le temps. Cette méthode permet ainsi d’étudier la manière dont les atomes se déplacent les uns par rapport aux autres.Variations avec l’ordre des propriétés physiques du milieuLa résistivité électrique est un paramètre particulièrement sensible à l’état d’ordre. Elle présente une discontinuité à la température critique Tc . Elle est plus faible dans l’état ordonné que dans l’état désordonné: en effet, le désordre, qui rompt la périodicité stricte, est un défaut qui introduit une nouvelle cause de résistance à la propagation des électrons dans le cristal. La mesure de la résistivité électrique constitue donc une méthode efficace pour la détection de transformations ordre-désordre.Les propriétés mécaniques des alliages sont également modifiées et présentent des discontinuités à Tc . Réciproquement, d’ailleurs, le degré d’ordre peut être modifié par certains traitements mécaniques tels que les déformations plastiques. Remarquons à ce propos que des modifications peuvent être également obtenues par irradiations par des particules telles que des neutrons qui, par chocs, déplacent les atomes et augmentent le désordre.Les propriétés magnétiques de certains alliages dépendent elles aussi du degré d’ordre, ce qui est bien naturel puisque l’ordre dans les alignements de moments magnétiques est fonction de l’ordre dans l’arrangement des atomes porteurs de moments.Les propriétés thermodynamiques sont parmi les plus intéressantes. La chaleur spécifique présente un pic aigu à la température Tc . Le parallélisme avec le cas du ferromagnétisme, déjà évoqué plus haut, fait que Tc est parfois appelé point de Curie d’ordre. Le fait que le pic d’anomalie de la chaleur spécifique présente une «queue» vers les températures supérieures à T constitue une preuve que l’ordre à courte distance ne disparaît que progressivement au-dessus de Tc .Une trempe , c’est-à-dire un refroidissement rapide à partir d’une température supérieure à Tc , permet de conserver, à l’état métastable, la phase désordonnée dans le domaine de température correspondant à l’équilibre sous forme ordonnée. Un recuit peut ensuite rétablir l’état d’équilibre.4. Autres exemplesPour simplifier l’exposé, nous avons surtout raisonné sur des cas simples et en particulier, pour le désordre réticulaire , sur le cas des alliages simples. Mais, dans le domaine structural, le phénomène se manifeste également dans les cristaux mixtes ou solutions solides dans lesquels deux atomes ont des caractères chimiques assez semblables et des tailles assez voisines pour pouvoir se substituer l’un à l’autre et échanger leurs positions sans qu’il en résulte un trop grand changement d’énergie. Il suffit d’ailleurs parfois que deux types d’atomes jouent dans le cristal le même rôle structural. C’est le cas des aluminosilicates . Prenons l’exemple de KAlSi38, très commun dans la croûte terrestre sous deux formes: l’orthose (monoclinique) et le microcline (triclinique). La charpente structurale est formée par un enchaînement de tétraèdres d’oxygène aux centres de gravité desquels se trouve soit un ion Si4+, soit un ion A13+. Considérons l’ensemble des positions des ions Si4+ + Al3+, qui forme une matrice au sens évoqué ci-dessus: dans le microcline, les ions Si4+ + Al3+ sont ordonnés sur les nœuds de cette matrice; dans l’orthose, ils sont désordonnés, en ce sens qu’en chacun des sites les probabilités de trouver un Al3+ ou un Si4+ sont respectivement 1/4 et 3/4, conformément à la formule globale. Ici, le désordre conduit à une augmentation de la symétrie macroscopique (de triclinique à monoclinique). Ce changement de symétrie, accompagné d’une légère modification de la taille et de la forme de la maille cristalline, est d’ailleurs une conséquence naturelle et très souvent observée de la transformation ordre-désordre.Signalons enfin que si, jusqu’ici, nous avons essentiellement parlé de substitution et d’échange de deux atomes ou ions de types différents, l’un de ces atomes peut, dans certains cas, être remplacé par une lacune , c’est-à-dire l’absence d’atome. C’est le cas pour une structure dans laquelle un certain atome peut occuper indifféremment l’une ou l’autre de deux positions et sauter de l’une à l’autre. On peut dire alors qu’il y a un phénomène d’ordre-désordre pour le système ion-lacune. Une autre généralisation consiste à considérer les structures dans lesquelles une molécule peut posséder plusieurs orientations distinctes dans la structure; ce cas n’est pas rare dans les cristaux organiques.Toutes ces éventualités sont justiciables de considérations semblables à celles que nous avons exposées à propos des alliages et ont le même type de répercussions sur les propriétés physiques macroscopiques.En ce qui concerne les travaux relatifs au désordre topologique , ils débouchent aussi bien sur l’étude des liquides que sur celle des verres et des substances amorphes parmi lesquelles les semi-conducteurs amorphes, en particulier, prennent une importance technique croissante.Les cristaux liquides constituent un autre champ d’investigation des phénomènes d’ordre partiel. Ils offrent une très grande variété de circonstances et méritent à eux seuls une description particulière.Enfin, il faut retenir que les études mathématiques sur l’ordre dans la matière condensée sont encore loin d’être épuisées. De nouveaux concepts, tels que celui de la percolation , ont été introduits, dont les applications dépassent d’ailleurs largement le strict champ de l’ordre-désordre en physique.
Elles expriment la probabilité d P de trouver à la fois le centre d’un atome dans l’élément de volume d 1 centré sur le point 1, un autre dans le volume d 2 centré au point 2..., et un autre dans le volume ds centré au point s . Dans un solide, qui, mis à part l’agitation thermique des atomes, peut être considéré comme figé, ces probabilités sont indépendantes du temps. Dans un liquide, elles représentent une valeur moyenne dans le temps.Considérons d’abord d P(1) = n (1) 練 d 1. C’est tout simplement la probabilité de trouver un atome en un point, donc la densité locale dans l’échantillon. Si d P(1) est indépendante du choix du point (1), l’échantillon est homogène. Prenons maintenant d P(1, 2) = n (1, 2) 練 d 1 練 d 2. C’est la probabilité de trouver simultanément un atome en (1) et un autre en (2). Si l’échantillon est homogène et isotrope, cette probabilité ne dépend que de la distance entre les points (1) et (2). La fonction n (1, 2) est dite fonction de distribution par paires. On la désigne aussi sous le nom de fonction de distribution radiale et on la note g (r ): si on fixe l’origine sur un atome, g (r ) donne la probabilité de trouver un autre atome à la distance r . Appliquée à un cristal, cette fonction se présente comme une suite discontinue de pics (distribution de fonctions de Dirac) car les distances interatomiques ont des valeurs discrètes, mais, dans un milieu désordonné, c’est une fonction continue (fig. 5). L’analyse de g (r ) permet de déterminer la valeur moyenne de la distance et du nombre des premiers voisins d’un atome donné dans le milieu étudié. En fait, l’essentiel des informations sur l’arrangement atomique est contenu dans cette fonction g (r ) qui décrit au mieux l’ordre local . L’interprétation de g (r ) est plus délicate lorsque la substance n’est pas un corps simple mais comporte plusieurs sortes d’atomes. Enfin, les fonctions de distribution de rang supérieur à deux, n (1, 2, 3), n (1, 2, 3, 4)..., permettent d’apporter quelques raffinements, mais sont d’un maniement beaucoup plus lourd.2. Paramètres d’ordre à longue et courte distanceRevenons maintenant au type de désordre que nous avons qualifié de réticulaire et cherchons à définir des paramètres susceptibles de le décrire quantitativement. Pour faire image, référons-nous au cas de l’alliage AB déjà évoqué et décrit dans la figure 1. Deux options peuvent être prises. La première consiste à s’intéresser au voisinage immédiat de chacun des atomes, c’est-à-dire à l’ordre local , ou ordre à courte distance , comme nous venons de le faire dans le cas du désordre topologique. Soit Z le nombre de premiers voisins d’un site de la matrice. Supposons que ce site soit occupé par un atome A, le nombre Z peut être divisé en deux parts: Z sites occupés par des atomes B et Z par des atomes A. Le rapport 兀 = (Z 漣 Z )/Z peut être utilisé pour décrire l’ordre local, les nombres Z et Z représentant les valeurs moyennes prises sur l’ensemble des sites de la matrice. 兀 est appelé paramètre d’ordre à courte distance. Dans l’état parfaitement ordonné, on a Z = Z et Z = 0, donc 兀 = 1. Dans l’état parfaitement désordonné, Z = Z , chaque site étant occupé avec la même probabilité par A ou B quel que soit son entourage, donc 兀 = 0. Dans tous les états intermédiaires, on a donc 0 麗 兀 麗 1.Mais le fait que, pour ce type de désordre, une matrice subsiste permet aussi de définir un ordre à grande distance . Désignons par 見 et 廓 les réseaux formés respectivement par les sites occupés, d’une part, par les atomes A et, d’autre part, par les atomes B dans l’état ordonné. Dans un état désordonné, soit 1 le nombre d’atomes A occupant des sites 見 (ou le nombre d’atomes B occupant des sites 廓), N2 le nombre d’atomes B occupant des sites 見 (ou le nombre d’atomes A occupant des sites 廓) et N = 1 + 2 le nombre total de sites. On définit le paramètre 﨡 d’ordre à grande distance par le rapport: 﨡 = (N1 漣 2)/N. Lorsque l’ordre est parfait (N1 = N, 2 = 0), 﨡 = 1; lorsque le désordre est statistiquement parfait dans l’ensemble de la matrice (N1 = 2), 﨡 = 0. Pour tous les états intermédiaires, 0 麗 | 﨡 | 麗 1.Ces définitions des deux paramètres 兀 et 﨡 se généralisent aisément au cas de composés de formule Am Bn , où m et n peuvent être différents de l’unité (exemple: AuCu3).Le paramètre d’ordre à courte distance, 兀, est appelé paramètre de Bethe. Il reflète essentiellement les effets de corrélations, d’interactions entre atomes premiers et, à la rigueur, deuxièmes voisins. Le paramètre d’ordre à longue distance, 﨡, est nommé paramètre de Bragg-Williams, du nom des deux auteurs qui ont introduit l’étude des corrélations à grande distance dans les alliages.Reprenant l’image de l’alliage AB, on peut définir une variable 靖 qui prend la valeur + 1 sur un site A et 漣 1 sur un site B. On obtient alors ce qu’il est convenu d’appeler un modèle d’Ising , qui permet, par exemple, de travailler sur l’ordre de spins magnétiques.Les définitions étant posées, les méthodes de la thermodynamique statistique peuvent être mises en œuvre pour l’étude des variations de 兀 et de 﨡 en fonction de la température et pour la recherche des corrélations possibles entre 兀 et 﨡, les données de départ étant les potentiels d’interaction entre couples d’atomes A-A, B-B, et A-B. Ce problème a donné lieu à un très grand nombre de travaux (Bethe, Bragg et Williams, Ising...) dans lesquels le degré des approximations introduites est plus ou moins grand. Cependant, même dans le cas d’une approximation relativement grossière, on est toujours conduit au résultat schématisé par la figure 6, qui représente les variations de 兀 et de 﨡 en fonction de la température. Il existe une température critique Tc au-dessus de laquelle l’ordre à grande distance disparaît totalement. Un résidu d’ordre local subsiste au-dessus de Tc et ne s’évanouit que progressivement lorsque la température s’élève. Ce résultat relatif au phénomène d’ordre-désordre réticulaire ne surprend pas. La disparition brutale de l’ordre à grande distance au-dessus de Tc est un phénomène tout à fait comparable à celui de la fusion, où l’ordre cristallin, la matrice, disparaît brutalement. En revanche, dans l’alliage désordonné au-dessus de Tc , comme dans un liquide, un ordre local subsiste qui ne s’atténue que très progressivement ou même jamais complètement.3. Manifestations physiques macroscopiquesPour mettre en évidence une transformation ordre-désordre, la méthode la plus directe est la diffraction des rayons X, celle des électrons ou celle des neutrons. Mais l’état d’ordre influe de façon plus ou moins marquée sur toutes les propriétés physiques du milieu, qu’elles soient électriques, magnétiques ou mécaniques.Diffraction des rayons X, des électrons et des neutronsConsidérons à nouveau la figure 1. Dans l’état d’ordre a, la périodicité, rigoureuse, est celle qui est indiquée par la flèche. Dans l’état de désordre, seule la matrice reste périodique, le solide ne l’étant plus au sens strict. Cela correspond, dans le schéma adopté, à une périodicité moyenne en b moitié de la périodicité rigoureuse en a. On sait que la figure de diffraction correspond à une transformation de Fourier de l’espace physique que constitue le milieu diffractant. À une périodicité du diffracteur deux fois moins serrée correspond donc une densité linéaire de taches de diffraction deux fois plus grande: ainsi, lorsque l’on passe du désordre à l’ordre, de nouvelles taches apparaissent sur les diagrammes de diffraction. Elles sont dites taches d’ordre ou de surstructure . Leur étude quantitative permet de caractériser le degré d’ordre et permet en particulier de calculer les paramètres d’ordre.Pour que les taches de surstructure apparaissent effectivement, encore faut-il que les pouvoirs diffusants individuels des atomes A et B soient différents, sinon les deux schémas a et b (fig. 1) apparaîtront pour les rayons X comme identiques. C’est pratiquement le cas si les atomes A et B sont très voisins dans la classification périodique. Il est alors nécessaire d’utiliser d’autres particules diffractantes pour lesquelles A et B apparaîtront comme différents: c’est ainsi que la diffraction des neutrons rend de grands services dans l’étude de l’ordre-désordre. La diffraction des électrons est utile elle aussi, plus spécialement pour l’observation des phénomènes dans les échantillons en couches minces.Dans le cas du désordre topologique, ce sont également les méthodes de diffraction qui sont les plus commodes pour déterminer la fonction de distribution radiale g (r ) qui se déduit, par transformation de Fourier, de la répartition des intensités dans un diagramme de diffraction, qui est alors continu, et non plus formé de faisceaux discrets. En diffraction de neutrons , il est même possible d’aller plus loin. En effet, l’énergie des neutrons thermiques utilisés étant faible, elle peut varier de quantités relativement notables lorsque les atomes sur lesquels les neutrons se diffractent sont en mouvement. En mesurant non seulement le nombre de neutrons diffusés dans les différentes directions, mais aussi leur énergie, on peut, par transformation de Fourier, en déduire une fonction de distribution spatio-temporelle (van Hove) qui permet de décrire non seulement la géométrie moyenne du milieu, mais encore son évolution dans le temps. Cette méthode permet ainsi d’étudier la manière dont les atomes se déplacent les uns par rapport aux autres.Variations avec l’ordre des propriétés physiques du milieuLa résistivité électrique est un paramètre particulièrement sensible à l’état d’ordre. Elle présente une discontinuité à la température critique Tc . Elle est plus faible dans l’état ordonné que dans l’état désordonné: en effet, le désordre, qui rompt la périodicité stricte, est un défaut qui introduit une nouvelle cause de résistance à la propagation des électrons dans le cristal. La mesure de la résistivité électrique constitue donc une méthode efficace pour la détection de transformations ordre-désordre.Les propriétés mécaniques des alliages sont également modifiées et présentent des discontinuités à Tc . Réciproquement, d’ailleurs, le degré d’ordre peut être modifié par certains traitements mécaniques tels que les déformations plastiques. Remarquons à ce propos que des modifications peuvent être également obtenues par irradiations par des particules telles que des neutrons qui, par chocs, déplacent les atomes et augmentent le désordre.Les propriétés magnétiques de certains alliages dépendent elles aussi du degré d’ordre, ce qui est bien naturel puisque l’ordre dans les alignements de moments magnétiques est fonction de l’ordre dans l’arrangement des atomes porteurs de moments.Les propriétés thermodynamiques sont parmi les plus intéressantes. La chaleur spécifique présente un pic aigu à la température Tc . Le parallélisme avec le cas du ferromagnétisme, déjà évoqué plus haut, fait que Tc est parfois appelé point de Curie d’ordre. Le fait que le pic d’anomalie de la chaleur spécifique présente une «queue» vers les températures supérieures à T constitue une preuve que l’ordre à courte distance ne disparaît que progressivement au-dessus de Tc .Une trempe , c’est-à-dire un refroidissement rapide à partir d’une température supérieure à Tc , permet de conserver, à l’état métastable, la phase désordonnée dans le domaine de température correspondant à l’équilibre sous forme ordonnée. Un recuit peut ensuite rétablir l’état d’équilibre.4. Autres exemplesPour simplifier l’exposé, nous avons surtout raisonné sur des cas simples et en particulier, pour le désordre réticulaire , sur le cas des alliages simples. Mais, dans le domaine structural, le phénomène se manifeste également dans les cristaux mixtes ou solutions solides dans lesquels deux atomes ont des caractères chimiques assez semblables et des tailles assez voisines pour pouvoir se substituer l’un à l’autre et échanger leurs positions sans qu’il en résulte un trop grand changement d’énergie. Il suffit d’ailleurs parfois que deux types d’atomes jouent dans le cristal le même rôle structural. C’est le cas des aluminosilicates . Prenons l’exemple de KAlSi38, très commun dans la croûte terrestre sous deux formes: l’orthose (monoclinique) et le microcline (triclinique). La charpente structurale est formée par un enchaînement de tétraèdres d’oxygène aux centres de gravité desquels se trouve soit un ion Si4+, soit un ion A13+. Considérons l’ensemble des positions des ions Si4+ + Al3+, qui forme une matrice au sens évoqué ci-dessus: dans le microcline, les ions Si4+ + Al3+ sont ordonnés sur les nœuds de cette matrice; dans l’orthose, ils sont désordonnés, en ce sens qu’en chacun des sites les probabilités de trouver un Al3+ ou un Si4+ sont respectivement 1/4 et 3/4, conformément à la formule globale. Ici, le désordre conduit à une augmentation de la symétrie macroscopique (de triclinique à monoclinique). Ce changement de symétrie, accompagné d’une légère modification de la taille et de la forme de la maille cristalline, est d’ailleurs une conséquence naturelle et très souvent observée de la transformation ordre-désordre.Signalons enfin que si, jusqu’ici, nous avons essentiellement parlé de substitution et d’échange de deux atomes ou ions de types différents, l’un de ces atomes peut, dans certains cas, être remplacé par une lacune , c’est-à-dire l’absence d’atome. C’est le cas pour une structure dans laquelle un certain atome peut occuper indifféremment l’une ou l’autre de deux positions et sauter de l’une à l’autre. On peut dire alors qu’il y a un phénomène d’ordre-désordre pour le système ion-lacune. Une autre généralisation consiste à considérer les structures dans lesquelles une molécule peut posséder plusieurs orientations distinctes dans la structure; ce cas n’est pas rare dans les cristaux organiques.Toutes ces éventualités sont justiciables de considérations semblables à celles que nous avons exposées à propos des alliages et ont le même type de répercussions sur les propriétés physiques macroscopiques.En ce qui concerne les travaux relatifs au désordre topologique , ils débouchent aussi bien sur l’étude des liquides que sur celle des verres et des substances amorphes parmi lesquelles les semi-conducteurs amorphes, en particulier, prennent une importance technique croissante.Les cristaux liquides constituent un autre champ d’investigation des phénomènes d’ordre partiel. Ils offrent une très grande variété de circonstances et méritent à eux seuls une description particulière.Enfin, il faut retenir que les études mathématiques sur l’ordre dans la matière condensée sont encore loin d’être épuisées. De nouveaux concepts, tels que celui de la percolation , ont été introduits, dont les applications dépassent d’ailleurs largement le strict champ de l’ordre-désordre en physique.
Encyclopédie Universelle. 2012.
